地址:湖北省武汉市珞狮路122号邮编:430070
 绿色智能江海直达船舶与邮轮游艇研究中心
绿色智能江海直达船舶与邮轮游艇研究中心
近日,武汉理工大学与帝国理工学院、阿伯丁大学组成的联合团队在生物力学交叉学科领域取得重要研究进展。研究成果以“Blood-brain mechanics: How brain tissue responds to pulsatile blood flow dynamics”为题,发表于国际顶级力学期刊《International Journal of Mechanical Sciences》上,船舶邮轮中心为论文的第一完成单位。
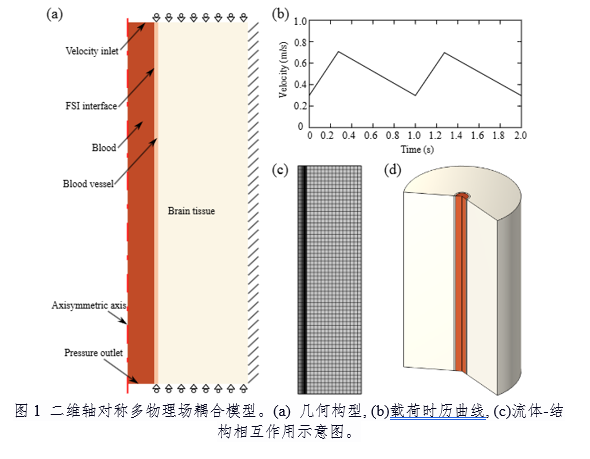
人脑作为高度复杂的软物质系统,其力学行为与脉动血流间的耦合机制是理解脑功能维持与病理损伤的关键。脑组织由灰质(GM)和白质(WM)构成,具有超粘弹性、各向异性等非线性力学特性,而脑血流呈现非牛顿流体特征。这种“流体-血管-组织”的强耦合作用,在高血压、脑卒中等疾病中会导致脑组织异常变形,但传统模型因简化材料属性或忽略多尺度耦合而难以精准刻画其动态响应,目前脉动血流引发的脑组织动态变形机制尚未被完全揭示。
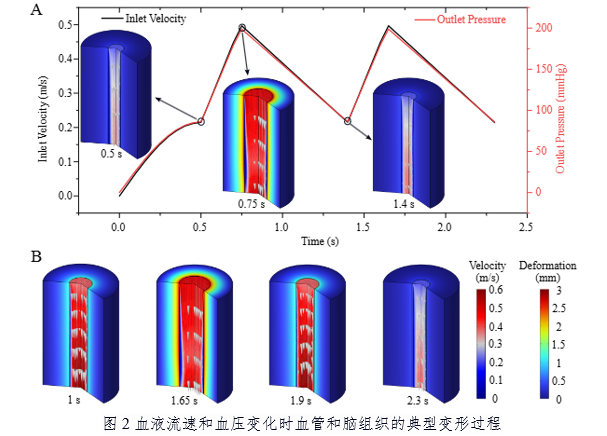
针对以上难点,研究团队构建了二维轴对称有限元模型(图1),创新性地将非牛顿流体(Oldroyd-B模型)、超弹性材料(Ogden模型)及超粘弹性材料(基于Storakers-Maxwell模型)整合至统一框架中,并通过双向流体-结构相互作用(FSI)耦合方案实现血液-血管-脑组织的动态交互(图2)。数值模拟结果表明:在高血压条件下,灰质(GM)位移较白质(WM)显著增加,且位移幅度随血压升高呈非线性增长(II期至III期高血压可翻倍,图3a);心率增加通过缩短加载周期间隔减少粘性耗散时间,从而抑制脑组织变形(图3f)。此外,血管直径扩大虽直接增加位移,但血管壁增厚可部分抵消该效应,揭示了脑血管结构与功能适应的力学机制(图4)。
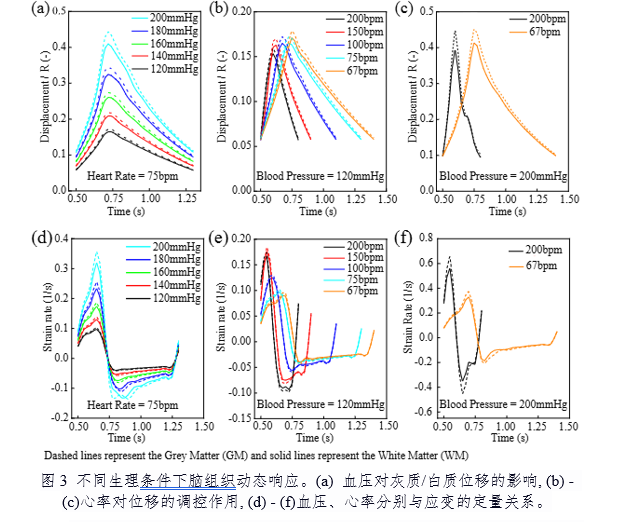
该模型的创新性体现在三个方面:首次建立涵盖血液-血管-脑组织全链条的力学模型;基于人脑灰质/白质压缩-松弛实验数据开发超粘弹性本构关系,精准捕捉时间依赖性非线性行为;揭示脉动血流与脑组织变形的动态关联,为神经退行性疾病机制研究提供力学解释。研究进一步发现,灰质在高血压条件下应变率显著高于白质,提示皮质区域更易受血流动力学异常影响(图4),该发现与临床观察到的阿尔茨海默病病灶分布具有潜在关联。
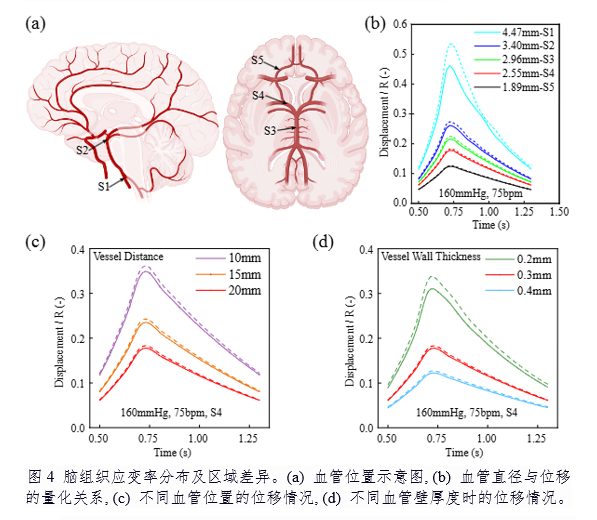
研究团队通过参数敏感性分析指出,血管直径增大(>20%)虽直接导致位移增加,但伴随的血管壁增厚(>15%)可形成负反馈调节,这种结构-功能耦合机制可能是脑血管系统长期进化的结果。此外,模型预测显示,心率在75-150bpm范围内对位移影响有限,但极端心率(<75bpm或>150bpm)会显著改变脑组织力学环境,为心律失常患者认知功能障碍研究提供了新视角。
该研究的意义与临床应用价值体现在三个方面:模型揭示高血压导致的GM过度变形可能与认知功能障碍直接相关,为“高血压-脑损伤”链条提供了力学解释;通过预测开颅后脑组织脉动,可辅助神经外科医生规划入路,减少术中脑移位误差;结合患者特异性血管几何(如CT/MRI数据),模型可评估药物递送效率或动脉瘤破裂风险,推动精准医疗发展。这项研究不仅深化了对脑-血液界面力学相互作用的理解,其开发的多物理场耦合模型还可拓展至创伤性脑损伤模拟、药物靶向输送优化等领域。
论文由武汉理工大学船舶邮轮中心吴卫国首席教授团队与帝国理工学院机械工程系Daniele Dini院士团队、阿伯丁大学工程学院詹文博教授等合作完成。吴卫国教授团队一直从事复杂结构非线性力学问题的数值仿真方法研究,Daniele Dini院士团队长期致力于生物力学与多物理场建模的交叉研究。论文第一作者是武汉理工大学的高晓圆博士,通讯作者为帝国理工学院的袁天博士,其他合作者包括帝国理工学院廖子陞博士及阿伯丁大学詹文博教授和杨弋博士。该研究获英国医学研究理事会(MRC)、中央高校基本科研专项资金等资助。
该研究成果体现了船舶邮轮中心与国际高校间的良好交流与合作,通过资源共享促进交叉学科的协同创新发展,不断扩大中心的国际影响力。
Xiaoyuan Gao, Tian Yuan*, Zisheng Liao, Yi Yang, Weiguo Wu, Wenbo Zhan, Daniele Dini. Blood–brain mechanics: How brain tissue responds to pulsatile blood flow dynamics. International Journal of Mechanical Sciences, 2025, 296, 110278.
论文链接:https://doi.org/10.1016/j.ijmecsci.2025.110278
(通讯员:高晓圆 编辑:徐丹 审核:孔祥韶)